ზადაქსინი / ZADAXIN
- საერთაშორისო დასახელება (აქტიური ნივთიერება): thimozil alfa 1
- კლინიკურ-ფარმაკოლოგიური ჯგუფი: ანტივირუსული საშუალებები
- მწარმოებელი კომპანია: მედიალი
- მწარმოებელი ქვეყანა: ესპანეთი
- გამოშვების ფორმა: 1.6 მგ ლიოფილური ფხვნილი კანქვეშ შესაყვანი საინექციო ხსნარის მოსამზადებლად ფლაკონი #2 და 1 მლ გამხსნელი ამპულა #2
- გაცემის რეჟიმი: II ჯგუფი (გაიცემა ფორმა N3 რეცეპტით)
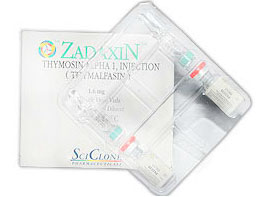
შემადგენლობა
ZADAXINtm თიმოზინ ალფა 1 (თიმალფასინი) არის ადამიანის თიმოზინ ალფა 1 იდენტური, ქიმიურად სინთეზირებული კანქვეშ შესაყვანი სუფთა სტერილური ლიოფილიზებული პრეპარატი. თიმოზინ ალფა 1 არის აცეტილირებული პოლიპეპტიდი შემდეგი შედეგებით: Ac-Ser-Aps-Ala-Ala-Val-Asp-Thr-Ser-Ser-Glu-Ile-Thr-Thr-Lys-Asp-Leu-Lys-Glu-Lys-Lys-Glu-Val-Val-Glu-Glu-Ala-Glu-Asn-OH, მისი მოლეკულური წონა შეადგენს 3,108 დალტონს. ლიოფიზებული პრეპარატი შეიცავს 1.6 მგ. თიმოზინ ალფა 1-ს, 50 მგ. მანიტოლს და ნატრიუმის ბუფერს pH - ის 6.8-მდე დასარეგულირებლად.
საინექციის პროდუქტი: მოხმარებამდე ლიოფილიზებული ფხვნილი გახსნილი უნდა იქნას 1 მლ მოცემულ გამხსნელში (საინექციო სტერილური წყალი). ხსნარში ZADAXIN - ის საბოლოო კონცენტრაცია შეადგენს 1.6 მგ/მლ.
ფორმა
ZADAXIN –ის ფორმაა ერთჯერადი ამპულა 1.6 მგ. ლიოფილიზებული თიმოსინ ალფა 1-ის შემცველობით თითოეულ ამპულაში. თითო მუყაოს კოლოფში არის ორი ZADAXIN –ის და აგრეთვე ორი ამპულას გამხსნელით ZADAXIN –სათვის, რომლებიც შეიცავს 1.0 მლ სტერილურ საინექციო წყალს.
ფარმაკოლოგიური თვისებები
წინა კლინიკური ფარმაკოლოგია: ZADAXIN - ის მოქმედების მექანიზმი ბოლომდე არ არის ცნობილი, თუმცა დადგენილია, რომ ის დაკავშირებულია იმუნომოდულატორულ აქტივობასთან., რომელიც კონცენტრირებულია თ-უჯრედების ფუნქციების გაზრდაზე. სხვადასხვა ხელოვნურ პირობებში შემოწმებისას თიმოზინ ალფა 1 ავლენს T -უჯრედების დიფერენციაციისა და განვითარების სტიმულირებას, მაგ.: აღმოჩნდა, რომ CD4+, CD8+ და CD3+ უჯრედების რაოდენობა იმატებს. აგრეთვე თიმოზინ ალფა 1 ზემოქმედებისას გამოვლინდა IFN-y -ის, IL–2-ის, IL–3-ის პროდუქციის მატება და მიტოგენებისა და ანტიგენების გავლენით IL-2 რეცეპტორის აქტივობის გაზრდა. მატულობს NK უჯრედების აქტივობა, იზრდება მიგრატორული ინჰიბირების ფაქტორის (MIF) პროდუქცია და T უჯრედებთან დაკავშირებული ანტიგენებისადმი მოპასუხე ანტისხეულების რაოდენობა. In vitro ვლინდება აგრეთვე თიმოზინ ალფა 1 ანტაგონისტური ეფექტი თიმოციტების დექსამეტაზონ-გამოწვეული აპოპტოზების მიმართ. თიმოზინ ალფა 1-ის გამოყენებამ In vivo - ცხოველებში, რომელთაც იმუნიტეტი დაქვეითებული აქვთ ქიმიოთერაპიით, სიმსივნური მასით ან დასხივებით აჩვენა, რომ თიმოზინ ალფა 1-ი ძვლის ტვინს იცავს ციტოტოქსიკური დაზიანებისაგან, სიმსივნის განვითარებისაგან და ოპორტუნისტული ინფექციისაგან, ამგვარად ახანგრძლივებს სიცოცხლეს და ზრდის გადარჩენილთა რიცხვს. თიმოზინ ალფა 1-ის In vitro და In vivo ეფექტები დადასტურებულია, როგორც პლურიპოტენტური ღეროვანი უჯრედის თომოციტში დიფერენციაციისა ან თიმოციტის აქტიურ T - უჯრედებში გადასვლის გამომწვევი
ფარმაკოკინეტიკა
შესწავლილ იქნა მოზრდილ მოხალისეთა შორის. თიმოზინ ალფა 1-ი შეყავდათ ერთჯერადი კანქვეშა ინექციის სახით 0.8 –დან 6.4 მგ–მდე რაოდენობით და მრავალჯერადი კანქვეშა ინექციით 1.6-დან 16 მგ-მდე 5-დან 7 განმაცლობაში. თიმოზინ ალფა 1-ი სწრაფად შეიწოვა სისხლში დაახლოვებით 2 საათში. დოზის პროპორციულად გაიზარდა Cmax და AUC და საწყის დონეს დაუბრუნდა მოხმარებიდან 24 საათის შემდეგ. ნახევარდაშლის პერიოდია დაახლოებით 2 საათი და აკუმულაციის ნიშნები არ შეიმჩნეოდა მრავალჯერადი კანქვეშა დოზის გამოყენების დროსაც. მიღებული დოზის 31%-დან 60%-მდე გამოყოფოდა შარდით.
ჩვენებები
ქრონიკული B ჰეპატიტი: ZADAXIN -ი გამოიყენება ქრონიკული ჰეპატიტ B-ს როგორც მონოთერაპიული, ასევე ინტერფერონთან ერთად კომბინირებული მკურნალობისათვის. ჩატარებული იქნა 3 რანდომიზებული გაკონტროლებული გამოკვლევა 223 ავადმყოფზე. თიმოსინ ალფა 1 გამოიყენებოდა კვირაში ორჯერ, 6 თვის განმავლობაში. განმეორებითი გამოკვლევა ჩატარდა 12 თვის შემდეგ მკურნალობის დასრულებისას (იხ. ცხრილი). მრავალჯერადი კვლევის შედეგად დადგინდა, რომ ZADAXIN -ის მოქმედება გრძელდება მკურნალობის დასრულების შემდეგ 12 თვის ან უფრო მეტი ხნის მანძილზეც კი. ZADAXIN - ით მკურნალობა უნდა გაგრძელდეს ALT - ს შესაძლო მომატების შემთხვევაშიც. ZADAXIN -ის მიღება უნდა შეწყდეს მხოლოდ ღვიძლის დაზიანებისა და ფუნქციის მკვეთრი მოშლის გამოცლენის შემთცვევაში.
ქრონიკული C ჰეპატიტის სამკურნალოდ ZADAXIN - თიმოზინ ალფა 1 მოწოდებულია ინტერფერონთან კომბინაციაში. ჩატარებული იქნა 2 რანდომიზირებული გაკონტროლებული გამოკვლევა და 1 გაკონტროლებული გამოკვლევა. ისინი მოიცავდნენ 121 ავადმყოფს, რომლებიც იღებდნენ ZADAXIN -ი პლუს ინტერფერონს ან მხოლოდ ინტერფერონს. თიმოსინ ალფა 1 გამოიყენებოდა კვირაში ორჯერ 6-დან 12 თვის მანძილზე, ხოლო ინტერფერონი კვირაში სამჯერ ასევე 6-12 თვის განმავლობაში. შედეგების შეფასება მოხდა მკურნალობისას და მკურნალობის დასრულებიდან 6 თვის შემდეგ (იხ. ცხრილი).
მონოთერაპია თიმოსინ ალფა 1-ის ეფექტურობა ქრონიკული B ჰეპატიტის მიმართ
| კვლევა რეფერენსი | პაციენტთა რაოდენობა სამკურნალო ჯგუფი | მკურნალობაზე პასუხი 12 თვის შემდეგ |
|---|---|---|
| US ფაზა 2 [1,5] | 12 თიმოსინ ალფა 1 (1.6 მგ. SQ BIW 6თვე) 8 პლაცებო | (83%) თიმოსინ ალფა 1 (25%) placebo |
| US ფაზა 3 [2,5] | 50თიმოსინ ალფა 1 (1.6 მგ. SQ BIW 6თვე) 49 placebo | (24%) თიმოსინ ალფა 1 (12%) placebo |
| ტაივანის ფაზა 3 [3,4,5] | 50თიმოსინ ალფა 1 (1.6 მგ. SQ BIW 6თვე) 53 უმკურნალებელი | (37%) თიმოსინ ალფა 1 (25%) უმკურნალებელი |
| საერთო მონაცემები [5] | 113 თიმოსინ ალფა 1 (1.6 მგ. SQ BIW 6თვე) 110 პლაცებო ან უმკურნალებელი | (36%) თიმოსინ ალფა 1 (19%) placebo ან უმკურნალებელი |
შედეგების ანალიზმა აჩვენა, რომ მკურნალობის დასრულებიდან 6-12 თვის მანძილზე მყარი ბიოქიმიური პასუხი, წარმოდგენილი ALT ნორმალური მონაცემებით, აღინიშნებოდა პაციენტების 22.4%-ში, რომლებიც გადიოდნენ კომბინირებული მკურნალობას, ხოლო მხოლოდ ინტერფერონით მკურნალობისას 9.3%-ში.
მიღების წესები და დოზები
ZADAXIN – ის გამოიყენება კანქვეშა აცრისთვის და არ უნდა იქნას გამოყენებული ვენაში. ის უნდა გაიხსნას 1.0 მლ ხსნარში, რომელიც შედგება 1.0 მლ სტერილური საინექციო წყლისაგან. ეს ყოველივე დაუყოვნებლივ უნდა იქნას გამოიყენოს მისი გახსნის შემდეგ. ექიმის გადაწყვეტილებით პაციენტს შესაძლოა აეხსნას ამ პრეპარატის თვითგამოყენება.
ქრონიკული B ჰეპატიტი:
ZADAXIN –ის როგორც მონოთერაპიის ან ინტერფერონთან კომბინაციის გამოყენებისას, ქრონიკული B ჰეპატიტის სამკურნალოდ, რეკომენდებულია შემდეგი დოზა: 1.6 მგ (900 ug /მ2) კანქვეშ, კვირაში ორჯერ, 6-12 თვემდე. პაციენტებმა, რომელთა წონა 40 კგ. ნაკლებია ZADAXIN –ი უნდა მიიღონ 40 ug /კგ.
ქრონიკული C ჰეპატიტი:
ZADAXIN –ის ინტერფერონთან კომბინაციაში გამოყენებისას, ქრონიკული C ჰეპატიტის სამკურნალოდ, რეკომენდებულია შემდეგი დოზა: 1.6 მგ (900 ug /მ2) კანქვეშ, კვირაში ორჯერ, 6-12 თვემდე. პაციენტებმა, რომელთა წონა 40 კგ. ნაკლებია ZADAXIN –ი უნდა მიიღონ 40 ug /კგ.
გვერდითი მოვლენები
ZADAXIN – I ადვილად ასატანია. კლინიკური კვლევაში, სადაც ჩართული იყო დაახლოვებით 2000 ინდივიდი, რომლებსაც სხვადასხვა დაავადება სჭირდათ და განთავსებულნი იყვნენ სხვადასხვა ასაკის ჯგუფებში, არავითარი არასასურველი შედეგი არ გამოვლინდა თიმოსინ ალფას მოხმარებისას (იხ. ქვემოთ მოცემული ცხრილი).
არასასურველი შედეგი იშვიათ და რბილ ფორმებში გამოიხატა, რომელიც ძირითადად გამოწვეული იყო აცრის ადგილის დისკომპორტით და ერითემის იშვიათი გამონაკლისით, ხანმოკლე კუნთების ატროფია, პოლიართრალგია
| დაავადება | არასასურველი შედეგების პროცენტულობა | |
|---|---|---|
| ვირუსული ინფექცია | ქრონიკული B ჰეპატიტი ქრონიკული C ჰეპატიტი იმუნოდეფიციტი | < 1 % წამლით გამოწვეული უკურეაქცია ყველანაირი აცრის მიმართ |
| კიბო | ფილტვის არაწვრილ უჯრედოვანი კიბო მელანომა | |
| დამხმარე ვაქცინაცია | B ჰეპატიტის ვაქცინა გრიპის საწინააღმდეგო ვაქცინა | |
| იმუნიტეტის მოშლა | ღვიძლის ავტოიმუნური დაავადება პირველადი იმუნური დეფიციტი | |
უკუჩვენება
ZADAXIN არ გამოიყენება თიმოსინ ალფა 1-ის ან მასში შემავალი ნებისმიერი კომპონენტის მიმართ მომატებული მგრძნობელობის შემთხვევაში. ვინაიდან ZADAXIN მოქმედებს, როგორც იმუნური სისტემის მასტიმულებელი საშუალება, ის არ უნდა გამოვიყენოთ ავადმყოფებში, რომელთავ ესაჭიროებად იმუნური სისტემის დათრგუნვა, მაგალითად ორგანო გადანერგილ ავადმყოფებში, სანამ თერაპიის პოტენციური დადებითი შედეგი აშკარად არ გადააჭარბებს პოტენციალურ რისკს.
თიმოსინ ალფა 1-ის ინტერფერონთან კონბინირებული თერაპიის ეფექტურობა ქრონიკული C ჰეპატიტის მიმართ
| კვლევა რეფერენსი | პაციენტთა რაოდენობა სამკურნალო ჯგუფი | პასუხის პროცენტი მკურნალობის ბოლოს* | 12 თვის შემდგომი პასუხის პროცენტი*** |
|---|---|---|---|
| US ფაზა 3 [6,9] | 35 თიმოსინ ალფა 1 + ინტერფერონი (Ta1 1.6 მგ. SQ BIW 6თვე + IFN 3 MU TIW 6თვე) 37 ინტერფერონი(IFN 3 MU TIW 6თვე) 37 placebo | ALT პასუხი (37.1%)თიმოსინ ალფა 1+ ინტერფერონი (16.2%) ინტერფერონ (2.7) placebo ვირუსული რეაქცია: (37.1%)თიმოსინ ალფა 1+ ინტერფერონი (18.9%) ინტერფერონი (2.7) placebo | ALT პასუხი (19.2%) თიმოსინ ალფა 1 + ინტერფერონი (9.4%) ინტერფერონი |
| იტალიური ფაზა2 [7,9] | 15 თიმოსინ ალფა 1 (1.0 მგ SQ qd 4 დღე შემდეგ BIW 51 კვირა + IFN 3 MU მე-4 დღეს TIW 51 კვ.) | ვირუსული რეაქცია: (73.3%)თიმოსინ ალფა 1+ ინტერფერონი | ვირუსული რეაქცია: (40.4%)თიმოსინ ალფა 1 + ინტერფერონი |
| იტალიური ფაზა3 [8,9] | 17თიმოსინ ალფა 1(1.6 მგ SQ BIW 6 თვე + IFN 3 MU TIW 6 თვე)17 ინტერფერონი | ALT რეაქცია: (70.6%)თიმოსინ ალფა1+ ინტერფერონი | ALT რეაქცია: (29.4%)თიმოსინ ალფა 1+ ინტერფერონი |
| საერთო მონაც. [9] [9] | 67თიმოსინ ალფა 1 (1.6 მგ SQ BIW 6-12 თვე +IFN 3 MU TIW 6-12 თვე) 54 ინტერფერონი | ALT რეაქცია (44.7%)თიმოსინ ალფა1 + ინტერფერონი (22.2%) ინტერფერონი+ | ALT რეაქცია (22.4%)თიმოსინ ალფა 1 + ინტერფერონი (9.3%) ინტერფერონი++ |
*ანალიზი დანიშნული მკურნალობიდან გამომდინარე
** ALT რეაქციის პროცენტულობა განისაზღვრება იმის და მიხედვით თუ მკურნალობის ბოლოს რამდენს აქვს ნორმალური ALT-ი. ვირუსული რეაქცია პროცენტულობა განისაზღვრება იმის და მიხედვით თუ 6 თვიანი დაკვირვების შემდეგ რამდენს ჰქონდათ HCV RNA - ს ნეგატიური შედეგი.
*** ALT რეაქციის პროცენტულობა განისაზღვრება იმის და მიხედვით თუ 6 თვიანი დაკვირვების შემდეგ რამდენს აქვს ნორმალური ALT -ი. ვირუსული რეაქცია პროცენტულობა განისაზღვრება იმის და მიხედვით თუ 6 თვიანი დაკვირვების შემდეგ რამდენს ჰქონდათ HCV RNA - ს ნეგატიური შედეგი. US ფაზა 3 მყარი შედეგი შეიცავს იმ პაციენტებს, რომლებიც 6 თვის მანძილზე გადიოდნენ მკურნალობას და ხელახლა დაავადებულები, რომლებიც 12 თვის მანძილზე გადიოდნენ მკურნალობას.
+P=0.0096
++P=0.10
გაფრთხილება
არანაირი
განსაკუთრებული მითითებები
ინფორმაცია პაციანტთათვის: პაციენტებმა ZADAXIN – ით მკურნალობა უნდა გაიარონ მხოლოდ დანიშნულებით, მათ უნდა ეცნოთ ყველა დადებითი შედეგი და რისკი. იმ შემთხვევაში თუ მკურნალობა დანიშნულია სახლის პირობებში ჩასატარებლად პაციენტი აუცილებლად უნდა მომარაგდეს შპრიცებისა და ნემსების საჭირო უსაფრთხო რაოდენობით. პაციენტს აუცილებლად უნდა აეხსნას შპრიცებისა და ნემსის სწორი მოხმარება და ხელახალი მოხმარების დაუშვებლობა. მათ უნდა აეხსნათ ZADAXIN – ის შენახვის სწორი პირობები: 2°-8°C (36° – 46° F). გახსნილი ZADAXIN –ი დაუყოვნებლივ უნდა იქნას გამოყენებული.
პრეპარატების ურთიერთმოქმედება და შეუთავსებლობა. ZADAXIN – ისა და სხვა პრეპარატების ურთიერთმოქმედება სრულად არ არის გამოკვლევული. ZADAXIN – ის თერაპიის სხვა იმუნომოდულირებად პრეპარატებთან შეთავსების შემთხვევაში აუცილებლად უნდა ჩატარდეს გამაფრთხილებელი ზომები. ZADAXIN – ი არ უნდა იქნას არეული სხვა რომელიმე პრეპარატთან ერთად.
კანცეროგენეზი, მუტაგენეზი, ნაყოფიერების გაუარესება: თიმოსან ალფა 1-ის ხანგრძლივი კვლევა არ იყო ჩატარებული კონცეროგენობის დასადგენად. თიმოსან ალფა 1-ის მუტაგენეტიკურმა კვლევამ არ გამოავლინა არასასურველი შედეგები.
ორსულთა კატეგორია C: თაგვებსა და კურდღლებზე ჩატარებული ტერატოლოგიური კვლევის შედეგად ნაყოფის დაზიანების თვალსაზრისით არ აღმოჩნდა არანაირი განსხვავება საკონტროლო და იმ ცხოველბს შორის, რომლებსაც აძლევდნენ თიმოსინ ალფა 1-ს. არ არის ცნობილი ის თუ ZADAXIN –ის მიღებამ ორსულ ქალებს შეიძლება შეუქმნას რაიმე ემბრიონალური ზიანი ან ზეგავლენა მოახდინოს გამრავლებაზე. ორსულმა ქალმა შეიძლება მიიღოს ZADAXIN – ი მხოლოდ იმ შემთხვევაში თუ მისი დადებითი შედეგი აშკარად აჭარბებს რისკს.
დედა რომელიც ბავშვს ძუძუთი კვებავს: არ არის ცნობილი ეს პრეპარატი გამოიყოფა თუ არა რძეში. ამგვარ შემთხვევაში ამ პრეპარატის მიღებამდე აუცილებლად უნდა მიღებული იქნას გამაფრთხილებელი ზომები.
გამოყენება ბავშვებში: 18 წელზე დაბლა ბავშვებისათვის უსაფრთხოება და ეფექტურობა არ არის დადგენილი.
ჭარბი დოზირება
ადამიანებში განზრახ ან შემთხვევითი გადამეტებული დოზირების შემთხვევები არ არის დაფიქსირებული. ცხოველთა ტოქსიკური კვლევის შედეგად ერთჯერადი 20 მგ/კგ-მდე დოზის და განმეორებითი 6 მგ/კგ-მდე/დღეში 13 კვირის განმავლობაში გამოყენებისას, რაც კვლევის ყველაზე დიდ დოზას წარმოადგენს, არ აღინიშნა უკურეაქცია. ცხოველებში ჩატარებული კვლევის ერთჯერადი, ყველაზე დიდი დოზა 800 ჯერ აღემატება კლინიკურ დოზას. ადამიანებზე დაკვირვებებისას 16 მგ-მდე ბიწ 4 კვირის მანძილზე არ აღმოჩნდა უკურეაქცია.
შენახვის პირობები და ვადები
შეინახეთ ZADAXIN –ი 2° დან 8° (36° - 46°) ტემპერატურაში. გახსნილი ZADAXIN –ი დაუყოვნებლივ უნდა იქნას მოხმარებული.
რეგისტრაციის # და თარიღი
R 003009 09.08.07


 სად შევიძინოთ?
სად შევიძინოთ?